Maladies rares
Les maladies rares touchent un nombre limité de personnes (moins de cinq personnes sur 10 000) : rapporté à la population, cela signifie qu’une même maladie rare concernera moins de 30 000 personnes en France.
– En France, trois millions de personnes sont concernées
– Environ 7000 maladies rares sont recensées et 200 à 300 nouvelles sont découvertes chaque année
– 80% d’entre elles sont d’origine génétique
– Elles concernent dans la moitié des cas des enfants de moins de 5 ans et sont responsables de 10% des décès entre un an et 5 ans
NB : On emploie le terme de « maladie orpheline » pour désigner une pathologie rare ne bénéficiant pas d’un traitement efficace.
La loi relative à la politique de santé publique promulguée le 9 août 2004 place la lutte contre les maladies rares comme l’une des cinq priorités de santé publique. Elle a donné lieu à trois plans nationaux maladies rares successifs.
Les Plans Nationaux de Santé Publique Maladies Rares ont permis de structurer une organisation de qualité par la mise en place de filières de santé qui regroupent les centres expertises et les plateformes d’expertise des maladies rares.
Il existe 23 filières de santé maladies rares chacune couvrant un champ large et cohérent de maladies, soit proches dans leurs manifestations, leurs conséquences ou leur prise en charge, soit responsable d’une atteinte d’un même organe ou système.

Une filière de santé maladies rares (FSMR) est rattachée à un établissement de santé et placée sous la responsabilité d’un responsable médical. C’est une structure qui rassemble et coordonne un ensemble de professionnels de santé impliqués dans la maladie rare et leur prise en charge.
Il existe 23 FSMR chacune couvrant un champ large et cohérent de maladies, soit proches dans leurs manifestations, leurs conséquences ou leur prise en charge, soit responsables d’une atteinte d’un même organe ou d’un système.
Les filières regroupent des centres de références (CRMR), de compétence maladies rares (CCMR), des professionnels de santé, des laboratoires de diagnostic et de recherche, des sociétés savantes, etc. qui concordent à répondre aux enjeux des maladies rares.
Depuis 2004, les centres experts des maladies rares sont labellisés tous les 5 ans par le Ministère de la Santé. Ils permettent aux patients et à leurs familles de bénéficier d’une prise en charge coordonnée et adaptée, de développer une expertise clinique et de recherche et de favoriser l’accès pour les patients aux innovations thérapeutiques et technologiques.
Il existe en France : 122 centres de référence coordonnateurs, 394 centres de référence constitutifs et 1795 centres de compétences.
Un centre de référence rassemble une équipe hospitalière hautement spécialisée ayant une expertise avérée pour une maladie rare – ou un groupe de maladies rares – et qui développe son activité dans les domaines des soins, de l’enseignement-formation et de la recherche.
Les missions des centres de référence sont :
– la coordination et l’animation de la filière de soins ;
– l’expertise dans les maladies rares pour lesquelles il est labellisé. A ce titre, il doit organiser l’accès à l’information et exercer un rôle de conseil et d’appui auprès de ses pairs, hospitaliers et de ville dans le secteur sanitaire, mais aussi éducatif, médico-social et social. Les protocoles nationaux de diagnostic et de soins (PNDS : référentiels de bonne pratique portant sur les maladies rares) sont élaborés par les centres de référence ;
– le recours : il assure une prise en charge pluridisciplinaire et pluri-professionnelle pour le diagnostic, la prise en charge et le suivi des personnes concernées ou atteintes d’une maladie rare ;
– la recherche ;
– l’enseignement et la formation.
Un centre de compétence assure la prise en charge et le suivi des personnes atteintes de maladies rares au plus proche de leur domicile, sur la base d’un maillage territorial adapté et en lien avec le CRMR dont il dépend fonctionnellement.
Il rassemble une équipe hospitalière spécialisée ayant une expertise avérée pour une maladie rare ou un groupe de maladies rares. Il fait le lien avec les professionnels de santé hospitaliers ou de ville et avec les secteurs médico-social, éducatif et social sur son territoire de santé.
Un centre de compétence est encouragé à participer à l’enseignement et à la formation et à la recherche pour les maladies rares relevant de sa compétence.
Il suit les recommandations de bonnes pratiques existantes (dont les PNDS) et peut avoir recours à l’expertise d’un centre de référence en cas de besoin.
Pour les filières de santé MHEMO (maladies hémorragiques constitutionnelles), MUCO-CFTR (mucoviscidose et autres anomalies du CFTR) et FILSLAN (sclérose latérale amyotrophique et autres maladies du neurone moteur), ces missions – et notamment une prise en charge de proximité 24h/24h et 7j/7j – sont assurées par un centre de ressources et de compétence.
Les centres de références et les centres de compétences ont l’obligation de renseigner la banque nationale de données maladies rares (BNDMR).
Une mise à jour de la liste des réseaux des centres de référence maladies rares (CRMR) a été publiée au BO du 29/12/23.
L’Ile de France compte 74 centres de référence coordonnateur, 147 centres de référence constitutif et 235 centres de compétences (ou centre de ressources et de compétences).
Excel => onglet 1 : liste francilienne ; onglet 2 : liste nationale
Dans le contexte de tension d’approvisionnement en immunoglobulines humaines normales (IgHN), de nouvelles mesures ont été mises en place par l’ANSM en lien avec la DGOS afin d’encadrer les prescriptions des IgHN et de réserver leur utilisation aux situations jugées prioritaires et pertinentes (notes d’information ministérielles du 31/05/2018 et du 25/06/2019). Une actualisation de la hiérarchisation des indications a été réalisée selon 3 niveaux. De nouvelles recommandations ont par ailleurs été émises avec, pour certaines indications, la nécessité d’une validation préalable de la prescription par un centre de référence maladie rare ou par un avis spécialisé.
Afin d’optimiser et de faciliter la mise en application des recommandations ANSM relatives à la hiérarchisation des indications des IgHN, un tableau synthétique regroupant les coordonnées et modalités de demande d’avis auprès des réseaux de centres de référence est mis à disposition des établissements de santé. Ce document a été réalisé par l’OMEDIT IDF en collaboration avec le groupe d’experts IGHN d’Ile-de-France.
Chacune des 23 filières de santé maladies rares est dotée d’un observatoire des traitements depuis fin 2021 conformément à l’action 4.2 du PNMR 3 : « Créer un observatoire des traitements au sein des filières de santé maladies rares »
Le domaine d’intervention des observatoires est large : il couvre le champ du médicament, des dispositifs médicaux et des pratiques non médicamenteuses.
Les objectifs sont :
– De disposer d’un état des lieux des traitements utilisés dans les maladies rares
– D’identifier des candidats aux dispositifs d’accès compassionnel et précoce
– De réaliser une veille prospective afin d’anticiper l’impact des traitements en développement
La note d’information ministérielle du 20 mai 2021, qui précise le cadre d’intervention de l’observatoire, prévoit d’établir un recensement des pratiques de prescription hors AMM d’intérêt, à partir d’un cadre formalisé.
L’offre de soins pour les patients adultes atteints de cancers rares s’organise sur l’ensemble du territoire autour de 17 réseaux nationaux de référence. Cette organisation vise à garantir aux malades une prise en soins optimale. Elle s’est structurée depuis 2009, sous la coordination de l’Institut National du Cancer (INCa) avec la mise en place de réseaux nationaux de référence financés par la Direction Générale de l’Offre de Soins (DGOS). Chaque réseau est organisé autour d’un centre de référence et de plusieurs centres de compétence régionaux ou interrégionaux. Ainsi, tout patient atteint d’un cancer rare est assuré de bénéficier d’un diagnostic de certitude, par la mise en place au sein de ces réseaux, d’une relecture des prélèvements de sa tumeur, et d’un traitement approprié, par la discussion systématique de son cas par des experts de ce cancer rare, et ce, quel que soit son lieu de traitement.
A l’échelle de l’Union européenne, un appel à projets a permis l’identification à partir de décembre 2016 de réseaux européens de référence maladies rares et cancers rares (European Reference networks ou ERN). Leur création vise à faciliter l’accès transfrontalier à l’expertise des patients atteints de maladies rares ou de cancers rares.
Ministère de la santé – « Maladies rares »
Ministère de la santé – Plan National des Maladies Rares 2018 – 2023
HCSP/HCERES – Rapport conjoint : évaluation du plan national maladies rares 3 (2018-2023)
Filières de santé maladies rares
Filières de santé maladies rares – Outilthèque
Légifrance – loi relative à la politique de santé publique promulguée le 9 août 2004
Médicaments orphelins
Un médicament est dit « orphelin » lorsqu’il est destiné au traitement de maladies rares.
Répartition par aires thérapeutiques des opinions positives pour des désignations orphelines 2000 – 2020
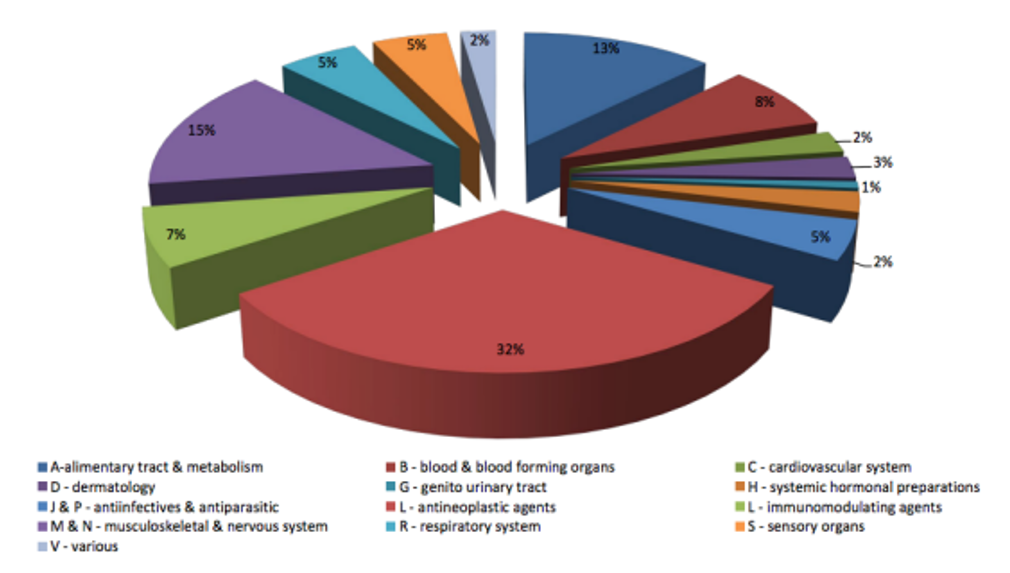
Source : Fraisse, T. (2023). Médicaments orphelins au sein de l’UE : environnement réglementaire, analyse du maintien du statut orphelin au moment de la procédure de mise sur le marché et de la démonstration du bénéfice significatif (Diplôme d’Etat de Docteur en Pharmacie, Faculté de Pharmacie de Montpellier).
Un médicament est désigné comme « orphelin », s’il répond aux critères suivants :
– Soit, il est destiné au diagnostic, à la prévention ou au traitement d’une affection entraînant une menace pour la vie ou une invalidité chronique ne touchant pas plus de 5 personnes sur 10 000 en Europe ;
OU
– Soit, il est destiné au diagnostic, à la prévention ou au traitement, en Europe, d’une maladie mettant la vie en danger, d’une maladie très invalidante ou d’une affection grave et chronique, et qu’il est peu probable que, en l’absence de mesures d’incitation, la commercialisation de ce médicament dans la Communauté génère des bénéfices suffisants pour justifier l’investissement nécessaire.
ET il n’existe aucune méthode satisfaisante de diagnostic, de prévention ou de traitement de cette affection ayant été autorisée en Europe pour la maladie considérée ; ou, s’il en existe, que le médicament en question procurera un bénéfice notable à ceux atteints de cette affection.
Résumé des critères à remplir afin d’obtenir une désignation orpheline
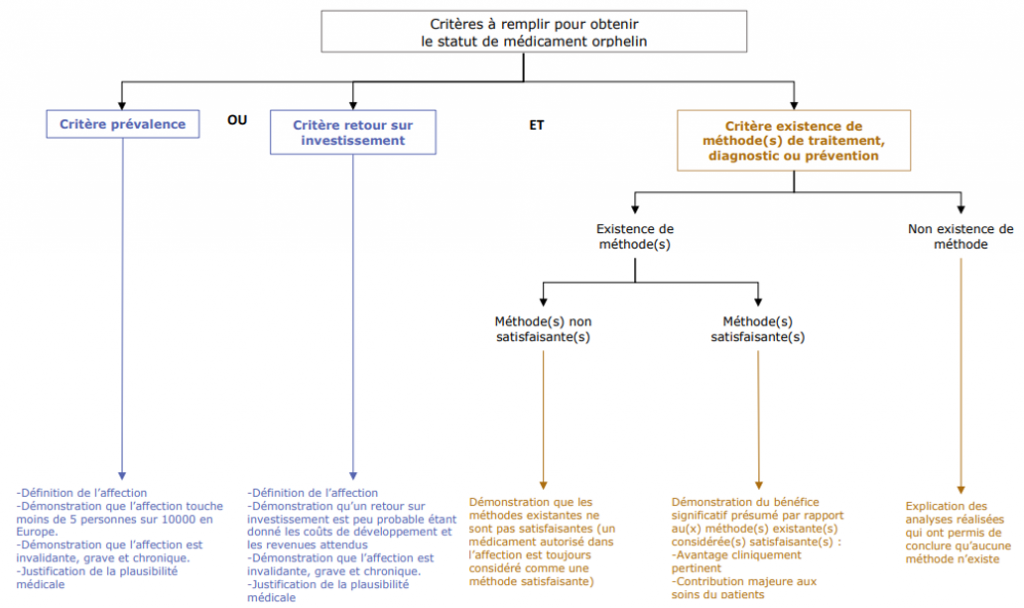
Source : Fraisse, T. (2023). Médicaments orphelins au sein de l’Union européenne : environnement réglementaire, analyse du maintien du statut orphelin au moment de la procédure de mise sur le marché et de la démonstration du bénéfice significatif (Diplôme d’Etat de Docteur en Pharmacie, Faculté de Pharmacie de Montpellier).
L’Agence européenne des médicaments (EMA), par l’intermédiaire de son Comité des médicaments orphelins (COMP), examine les demandes de désignation déposées par des structures souhaitant développer des médicaments orphelins. L’avis du COMP est ensuite transmis à la Commission européenne qui émet la décision finale dans un délai de 30 jours.
ATTENTION : La désignation de médicament orphelin n’est pas une autorisation de commercialisation. Cela ne signifie pas que le médicament satisfera aux critères de tolérance, d’efficacité et de qualité indispensables à l’octroi d’une Autorisation de Mise sur le Marché (AMM).
Différences clés entre la procédure initiale de désignation orpheline et la procédure de maintien du statut orphelin
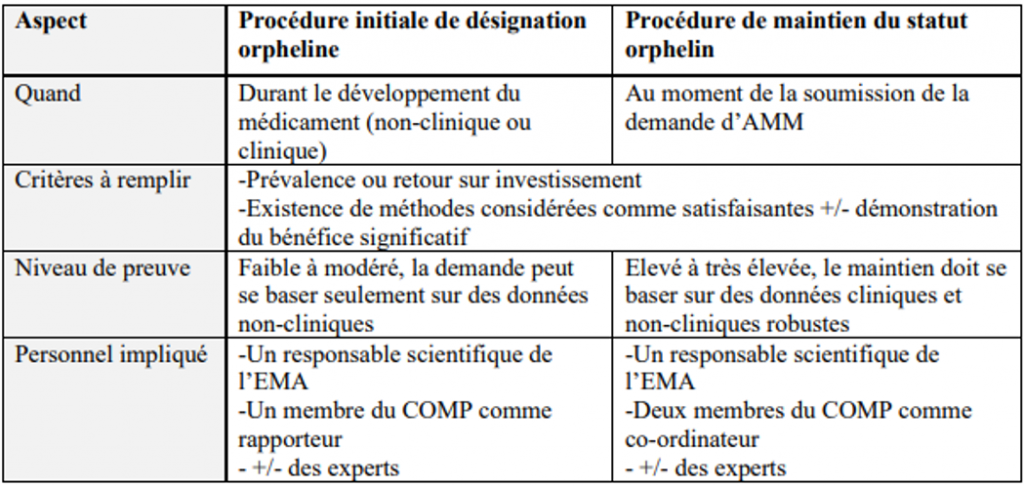
Source : Fraisse, T. (2023). Médicaments orphelins au sein de l’Union européenne : environnement réglementaire, analyse du maintien du statut orphelin au moment de la procédure de mise sur le marché et de la démonstration du bénéfice significatif (Diplôme d’Etat de Docteur en Pharmacie, Faculté de Pharmacie de Montpellier).
Seuls les médicaments désignés comme orphelins qui ont conduit à leur terme des essais cliniques, et pour lesquels les résultats de ces essais attestent d’un rapport bénéfice/risque favorable, peuvent faire l’objet d’une AMM.
Les médicaments désignés comme orphelins relèvent exclusivement du régime de l’AMM communautaire, dite centralisée, délivrée par la Commission européenne. L’obtention d’une AMM européenne ne signifie pas que le médicament est disponible dans l’ensemble des Etats membres. En France, pour que le médicament orphelin soit remboursable par la Sécurité sociale ou disponible en milieu hospitalier, la Commission de la transparence de la Haute autorité de santé doit évaluer favorablement l’apport du médicament par rapport aux thérapeutiques existantes.
La réforme de l’accès dérogatoire aux médicaments renforce l’accès aux traitements innovants pour les patients en impasse thérapeutique. Dans certaines conditions, les médicaments orphelins peuvent être disponibles pour le patient avant l’obtention d’une AMM.
Depuis juillet 2021, les autorisations d’accès précoce (AAP) et d’accès compassionnel (AAC), les cadres de prescription compassionnelle (CPC) remplacent les dispositifs d’autorisation temporaire d’utilisation (ATU) et de recommandation temporaire d’utilisation (RTU).
Retrouvez sur cette page toutes les informations concernant la refonte du système d’accès dérogatoire aux médicaments
Autorisation d’accès précoce (AAP) :
Elle peut être demandée par le laboratoire pharmaceutique afin de mettre à disposition plus rapidement un médicament innovant pour une maladie grave et/ou rare. Il peut s’agir d’un médicament dépourvu d’AMM ou ayant une AMM pour une autre indication (extension d’indication). Le laboratoire devra déposer une demande d’AMM dans les 2 ans qui suivent.
Autorisation d’accès compassionnel (AAC) :
Elle peut être demandée par un médecin prescripteur pour un médicament sans AMM en France, ou en cours d’essai clinique. Elle vise les médicaments non nécessairement innovants, qui ne sont initialement pas destinés à obtenir une AMM, mais répondent de façon satisfaisante à un besoin thérapeutique non couvert.
Cadre de prescription compassionnelle (CPC) :
L’ANSM peut encadrer une pratique de prescription hors-AMM d’un médicament ayant une AMM pour une autre indication.
Retrouvez dans notre rubrique Juste Prescription des documents sur le bon usage et le financement des médicaments orphelins relevant de la liste en sus