Objectif : Renforcement du suivi (analytique, épidémiologique et de bon usage) compte tenu des enjeux de sécurité sanitaire relatifs à ces DM.
1/ Quels sont les DM concernés ?
La liste consolidée des DM inscrits sur la liste dite « intra-GHS » est mise à jour au fur et à mesure de la publication de nouveaux arrêtés et disponible sur le site internet du ministère.
Actuellement, 10 catégories sont définies :

A noter : certaines catégories ne comprennent aucun DM : des DM relevant de ces catégories étant à ce jour inscrits sur la liste en sus
Pour être utilisé en établissement sanitaire, un DM relevant d’une des catégories citées ci-dessus doit être inscrit soit sur la liste intra-GHS, soit sur la liste en sus.
2/ Quels sont les établissements concernés ?
Ces fichiers sont à fournir pour tous les établissements sanitaires.
3/ Quelle est la forme du fichier de recueil ?
Le fichier de recueil est au format DATEXP. Les données suivantes sont recueillies :
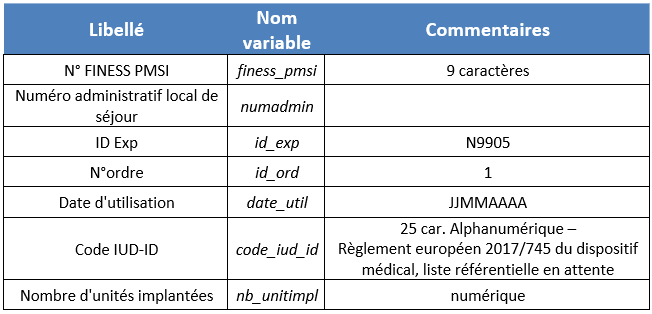
NB : un référentiel des IUD-ID (Identifiant dispositif propre à un fabricant et à un dispositif) des différents modèles et références commerciales des dispositifs inscrits sur la liste « intra-GHS » est mis à disposition des établissements de santé sur le site internet du ministère.
4/ Quelles sont les modalités de mise en œuvre de ce recueil ?
Les informations sont transmises à l’ATIH au moment de la facturation ou de la valorisation des prestations d’hospitalisation. La mise en œuvre de ce recueil est obligatoire à compter du 1er avril 2022.
Pour en savoir plus :
- Note d’information interministérielle relative à la mise en œuvre du recueil concernant les DM inscrits sur la liste dite « intra-GHS »
- Poster : Dispositifs médicaux « INTRA-GHS » : mise en œuvre du suivi des DM de cette liste (OMéDIT Centre-Val de Loire (30/03/2022))
- Webinaire relatif aux DM intra-GHS (OMEDIT Auvergne Rhône-Alpes)
L’acte de pose de bioprothèses valvulaires aortiques par voie artérielle transcutanée ou par voie transapicale (TAVI) ne peut être réalisé que dans les établissements de santé répondant à l’ensemble des critères définis par l’arrêté du 3 juillet 2012. Cet arrêté prévoit également :
-
-
- des contrôles par les agences régionales de santé (ARS) du respect de ces critères par les établissements de santé ;
- la mise en place de modalités de suivi des poses de TAVI par les observatoires régionaux mentionnés à l’article D. 162-16 du code de la sécurité sociale (Observatoires des Médicaments des Dispositifs Médicaux et des Innovations Thérapeutiques : OMEDIT).
-
Un envoi exhaustif de données doit être adressé aux OMEDIT afin de garantir le respect des indications et la bonne tenue d’une réunion de concertation pluridisciplinaire.
Les variables à transmettre à l’OMEDIT sont récapitulées dans l’annexe II de l’Instruction du 7 mars 2013.
Chaque établissement collige ces variables dans le cadre du registre France-TAVI. A partir de ce registre, un export trimestriel de l’ensemble des variables définies dans l’annexe II est réalisé par chaque établissement et transmis aux OMEDIT sous un format numérique exploitable.
Chaque OMEDIT assure la synthèse et l’analyse des données au niveau régional. Un rapport d’activité ainsi qu’un export de leur base de données sont envoyés par les OMEDIT à la DGOS afin de pouvoir disposer au niveau national d’une visibilité de l’activité et du respect des indications de pose sur l’ensemble du territoire français.
En Ile-de-France, 10 établissements pratiquent cette activité :
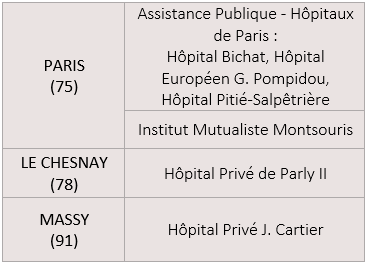
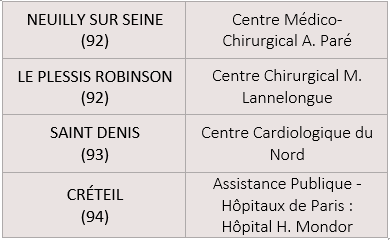
Rapport d’évaluation de la HAS (janvier 2024) : la HAS recommande en premier lieu de conserver les modalités d’encadrement existantes et souligne notamment la nécessité de disposer des plateaux de cardiologie interventionnelle et de chirurgie cardiaque sur site.
Cette évaluation soulève la question des délais d’attente. Pour réduire ces délais, la HAS encourage d’optimiser le parcours de soins des patients en : 1/ Créant des filières spécifiques au TAVI et en favorisant notamment l’accès aux examens d’imagerie ; et 2/Permettant aux chirurgiens cardiaques d’implanter des TAVIs par voie transfémorale sous conditions.
Si après 1 an de mise en place de ces mesures, il existe des délais d’attente régionaux prohibitifs, la HAS est favorable à la mise en place d’une expérimentation pour une durée de 3 ans dans des centres ne disposant pas de chirurgie cardiaque sur site et sous conditions de plateau technique et de compétences. Ceci suppose que puissent être objectivés ces délais d’attente ainsi que la temporalité notamment par la complétude de remplissage du registre France TAVI qui pourra être analysé au niveau local par les Agences Régionales de Santé qui réaliseraient un diagnostic et proposeraient, le cas échant, d’autoriser la pose de TAVI dans de nouveaux centres sans chirurgie cardiaque sur site.
Ces agences se prononceraient également en prenant en compte l’évolution de la démographie et de la disponibilité des cardiologues interventionnels afin de garantir le juste accès aux soins cardiologiques et conserver ainsi un maillage territorial optimal et indispensable en particulier pour la prise en charge des urgences coronaires par angioplastie. Cette proposition nécessite des concertations complémentaires avec tous les acteurs concernés.
En dernier lieu, la HAS recommande plusieurs pistes pour rendre obligatoire le remplissage du registre France TAVI afin de suivre les pratiques et de pouvoir suivre dans les meilleures conditions possibles les résultats liés à l’expérimentation.
Registre FRANCE-TAVI
Le registre FRANCE-TAVI évolue. Il devient FRANCE-TAVI SDNS et a pour but de simplifier la saisie des données (2019).
Evaluations conduites par la HAS
Aspects réglementaires
- Arrêté du 22 décembre 2021 subordonnant la prise en charge des produits de santé autres que les médicaments inscrits sur la liste prévue à l’article L. 165-11 du code de la sécurité sociale par l’assurance maladie au recueil et à la transmission de certaines informations relatives à leur usage, en application de l’article L. 162-17-1-2 du code de la sécurité sociale
- Note d’information n° DGS/PP3/DGOS/DSS/2016/102 du 4 avril 2016 relative à la mise en place du dispositif d’évaluation des dispositifs médicaux financés dans les tarifs des prestations d’hospitalisation, dit « intra-GHS »
- Arrêté du 5 août 2020 relatif à la modification de la date de fin d’inscription des catégories homogènes inscrites au chapitre 1 et 2 du titre I de la liste des produits de santé financés au titre des prestations d’hospitalisation prévue à l’article L. 165-11 du code de la sécurité sociale. [date de fin d’inscription sur la liste intra-GHS est fixée au 22 juillet 2022 pour certains défibrillateurs cardiaques]
- Arrêté du 16 décembre 2020 modifiant arrêté du 28 mars 2019 limitant la pratique de l’acte de pose de bioprothèses valvulaires aortiques par voie transcathéter à certains établissements de santé en application des dispositions de l’article L. 1151-1 du code de la santé publique. [Validité des critères d’éligibilité des établissements jusqu’au 01/06/2024]
- Arrêté du 28 mars 2019 limitant la pratique de l’acte de pose de bioprothèses valvulaires aortiques par voie transcathéter à certains établissements de santé en application des dispositions de l’article L. 1151-1 du code de la santé publique [les modifications apportées par rapport à l’Arrêté du 03/07/2012 apparaissent en jaune]
- Instruction n°DGOS/PF4/2013/91 du 7 mars 2013 relative aux modalités de suivi par les ARS et les OMEDIT de l’acte de pose de bioprothèses valvulaires aortiques par voie artérielle transcutanée ou par voie transapicale

