Sérialisation : où en est-on ?
Mis à jour le 17 avril 2023
Sérialisation : où en est-on ?
Mise à jour le 17/04/2023
Également appelée « traçabilité à la boite », la sérialisation est un système de vérification de l’authenticité d’un médicament entre sa mise en distribution et sa dispensation au patient.
Selon France MVO, ce système consiste à venir apposer un identifiant unique sur chaque boite de médicaments qui sera ensuite chargé dans une base de données centrale. En sus de cet identifiant unique, un dispositif antieffraction vient compléter chaque boite de médicaments sérialisée.
A l’heure où l’Union Européenne doit faire face aux médicaments falsifiés, de nouveaux textes visant à garantir l’authenticité des médicaments ainsi que leur intégrité devraient permettre une meilleure sécurisation du circuit du médicament.
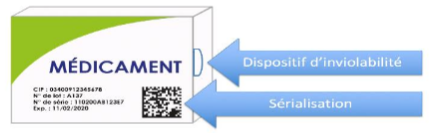

DataMatrix, quelles informations y sont contenues ?
Il s’agit d’un identifiant unique contenant le n° de série, code CIP, n° de lot, date de péremption.
En 2011, la directive européenne 2011/62/UE (art.54) dite « Médicaments falsifiés », prévoyait des mesures à mettre en place pour sécuriser la chaîne de distribution du médicament dans toute l’Union européenne, parmi lesquelles l’authentification des médicaments et ce via deux “dispositifs de sécurité” apposés sur les boîtes de médicaments :
- Un “dispositif anti-effraction”,
- Un marquage DataMatrix embarquant un identifiant unique à chaque boîte de médicament.
En 2016, le règlement européen délégué 2016/161 de la Commission Européenne est venu préciser les modalités d’authentification des médicaments à la boîte et indique que la sérialisation à la boite entre en vigueur le 9 février 2019.
Le règlement européen, directement applicable en France, établit un système dans lequel l’identification et l’authentification de médicaments seront garanties par une vérification de bout en bout de la chaîne d’approvisionnement de tous les médicaments dotés des dispositifs de sécurité. Le dispositif de sérialisation repose sur le chargement préalable des identifiants uniques dans le système de répertoires, par le titulaire d’AMM ou le distributeur parallèle.
En ville ou en établissement de santé, le pharmacien, en scannant les boîtes, interrogera la base de données nationale qui lui garantira l’authenticité du produit délivré.
-
Février 2018
Dans sa note d’information du 8 février 2018, le ministère des solidarités et de la santé rappelle aux pharmacies d’officine et établissements de santé (PUI) leur rôle et nouvelles obligations.
Ainsi, toute personne autorisée ou habilitée à délivrer des médicaments au public aura l’obligation de vérifier l’intégrité de chaque boite et de désactiver l’identifiant unique.
Ces deux opérations doivent être effectuées à des moments précis mais qui diffèrent selon le lieu d’exercice des personnes habilitées à délivrer des médicaments au public :
– Pour une délivrance effectuée en pharmacie d’officine, ces opérations devront être effectuées au moment de la délivrance ;
– Pour une délivrance effectuée en PUI, ces opérations peuvent être effectuées aussi longtemps que le médicament se trouve en la possession matérielle de l’établissement.
Ces nouvelles obligations obligent les pharmacies d’officine et les établissements de santé à s’équiper d’un système permettant de vérifier l’identifiant unique de chaque boite de médicaments en réalisant les opérations suivantes :
- Lecture du code
- Connexion au système national de répertoire « France Medicines Verification System » (France MVS)
- Désactivation (« décommissionnement ») du code après confirmation de l’authenticité de l’identifiant unique
Le ministère ajoute qu’une phase pilote débutera prochainement avec des pharmacies d’officine et des établissements de santé.
-
Août 2018
Publication le 06/08/2018 d’une Note d’information N° DGOS/PF2/DGS/PP2/2018/196 du 2 août 2018 visant à informer les établissements de santé de la publication d’un guide méthodologique relatif au déploiement du dispositif sérialisation : Lutte contre la falsification des médicaments dans les Établissements de Santé
Ce guide s’articule autour de 3 chapitres : dispositif réglementaire, pilotage des répertoires de vérification et étapes du déploiement de la sérialisation. Il a vocation à apporter aux établissements de santé un éclairage sur la démarche à mettre en œuvre. Il ne présente cependant pas une classification stricte des solutions et ne prétend pas être exhaustif car des aspects organisationnels sont encore discutés au niveau européen.
Néanmoins, compte tenu de la date limite fixée au 9 février 2019, il est apparu important de disposer des principales lignes directrices pour élaborer une stratégie de mise en œuvre. Le guide a vocation à répondre aux questionnements des pharmaciens et fournit des orientations à propos des règles spécifiques précisées dans le règlement délégué.
La mise en œuvre de ces recommandations repose sur l’engagement de tous. Compte tenu des disparités des organisations, il appartient aux responsables des établissements disposant d’une PUI en collaboration avec les pharmaciens chargés de la gérance responsables de cette activité (L. 5126-3, I du CSP), de prendre les décisions adéquates sur la façon dont le règlement européen doit être mis en œuvre au plus tard le 9 février 2019.
L’authentification des médicaments à risque entre en application le 9 février 2019. Compte tenu des adaptations techniques et organisationnelles chez tous les acteurs de la chaîne pharmaceutique, une mise en œuvre progressive pourrait être envisagée (cf. note DGS-DGOS en bas de page)
-
Janvier 2019
L’authentification des médicaments à risque entre en application le 9 février 2019.
Compte tenu des adaptations techniques et organisationnelles chez tous les acteurs de la chaîne pharmaceutique, une mise en œuvre progressive pourrait être envisagée : Note d’information n°DGOS/PF2/DGS/PP2/2019/20 du 31 janvier 2019
Il est précisé dans la note au paragraphe III :
-
Juin 2019
Le Décret 2019-592 du 14 juin 2019 précise les modalités de désactivation pour un tiers des identifiants uniques.
L’exonération de vérification des dispositifs de sécurités dont sont dotés les médicaments et de désactivation de l’identifiant s’applique :
– aux établissements ne disposant pas de pharmacie à usage intérieur (PUI),
– aux cabinets vétérinaires, infirmiers, dentiste ou d’anesthésie,
– aux établissements de ravitaillement sanitaire du service de santé des armées
– aux établissements pharmaceutiques de l’Agence Nationale de Santé Publique (ANSP)
– dans les centres médicaux de service de santé des armées (SSA)
– dans les services d’incendie et de secours (SDIS)
> Qui « décommissionne » ?
Le décret précise qu’il s’agit de l’ « établissement pharmaceutique d’une entreprise ou d’un organisme se livrant à la vente en gros, à la cession à titre gratuit ou à la distribution en gros » qui « vérifie les dispositifs de sécurité et désactive l’identifiant unique » avant de délivrer les médicaments aux structures ou praticiens concernés.
Le praticien ou les structures sans Pharmacie à Usage Intérieur devront cependant s’assurer de « l’intégrité du dispositif antieffraction » lors de la délivrance du médicament au public.
-
Février 2021
Un arrêté publié au Journal Officiel le 27 février 2021 formalise « la lutte contre les médicaments falsifiés » au rang des bonnes pratiques de dispensation des officines.
Dans la partie « 4.Les obligations en matière de lutte contre la falsification des médicaments » de l’annexe de cet arrêté, sont rappelés :
- les obligations des pharmaciens concernant la mise en place du dispositif de sérialisation en vertu de la directive européenne 2011/62/UE (art.54)
- les médicaments concernés par le dispositif de sérialisation
Cet arrêté a été publié à la suite d’une concertation lancée le 11 décembre 2020 et à fait l’objet d’un DGS-Urgent n°2021-25 portant sur l’obligation des pharmaciens en matière de lutte contre la falsification des médicaments (03/03/2021).
Ainsi, le pharmacien doit, au moment où il dispense une boîte de médicaments au patient, vérifier l’intégrité du dispositif antieffraction, mais également, pour les médicaments concernés, interroger la base de données européenne qui recense l’ensemble des identifiants uniques (numéros de série) dont sont équipées chacune des boîtes.
A noter : selon l’Ordre National des Pharmaciens, début mars 2021, seules 233 sur plus de 21 000 étaient connectées au répertoire national de vérification des médicaments (NMVS).
-
Mars 2023
Selon les données ministérielles, 90 % des officines respectent leurs obligations de sérialisation des médicaments au 13 mars 2023. Objectif : 100 % des officines au plus tôt en 2023.
-
Avril 2023
Dans l’instruction n°DGOS/PF2/2023/45 du 6 avril 2023 publiée au BO Santé, il est rappelé aux PUI des établissements de santé et des établissements médico-sociaux leurs obligations prévues par le règlement délégué (UE) 2016/161 de la Commission du 2 octobre 2015 relative à la sérialisation :
Suite à une rencontre technique en date du 15 février 2023 avec la Commission européenne et afin d’éviter des sanctions pour non-respect des obligations de sérialisation, le ministère de la santé a dû fixer comme objectifs de mise en œuvre de ce dispositif au sein des PUI :
− 80% de PUI des établissements connectées en juin 2023 ;
− 90% de PUI des établissements connectées en septembre 2023 ;
− 100% de PUI des établissements connectées en décembre 2023.
A date, le taux de connexion national des PUI est de 74%.
Compte tenu des travaux qui restent à mener, le ministère de la santé encourage les acteurs à finaliser la mise en œuvre des obligations visant à protéger les patients contre la falsification.
-
Décembre 2023
Le décret n° 2023-1127 du 30 novembre 2023 publié au JO du 02/12/23 prévoit une pénalité financière (jusqu’à 2000 euros), renouvelable chaque trimestre, pour les pharmacies (pharmacies d’officine, mutualistes et de sociétés minières) ne respectant pas leurs obligations en matière de sérialisation à partir du 1er janvier 2024.
Le règlement européen précise les médicaments concernés par la sérialisation (annexes I et II) ainsi que le type de dispositif de sécurité attendu : un dispositif antieffraction et un identifiant unique.
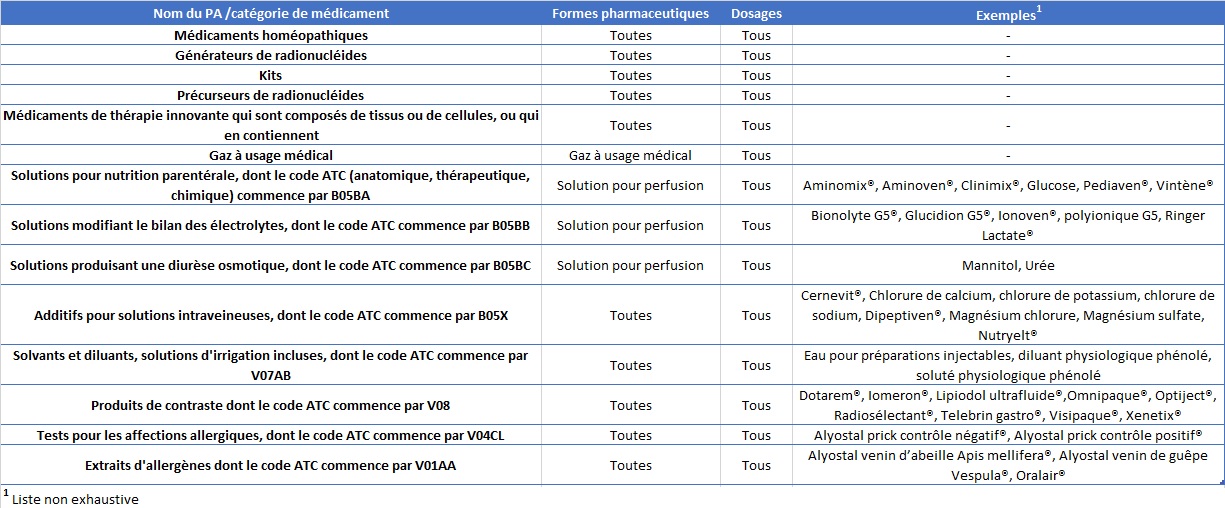
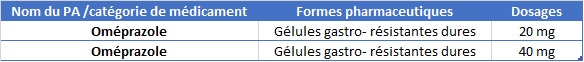
Si à première vue, seuls les médicaments soumis à prescription sont concernés par cette nouvelle obligation, le règlement vient apporter des exceptions dans ses annexes I et II :
Médicaments soumis à prescription ne devant pas disposer de dispositifs de sécurité (annexe I)
Médicaments non soumis à prescription devant disposer de dispositifs de sécurité (annexe II)
Pour toute information complémentaire, un organe de gouvernance a été institué dans chaque État membre afin de gérer ce nouveau système de répertoire. En France, le CIP a été choisi par les différents acteurs du médicament pour assurer la gouvernance de la sérialisation. Cette activité/mission est exercée/assurée sous le nom de « France MVO (Medicines Verification Organisation) ».
Une foire aux questions (FAQ) est disponible sur le site : http://www.france-mvo.fr/
Pour aller plus loin :
-
- Page Ministère de la santé « La sérialisation en officines pour contribuer à la lutte contre la falsification des médicaments » Nouveau !
- FAQ Ministère de la santé « La sérialisation en officine » Nouveau !
- Page & Communiqué de Presse du Ministère de la santé « Sérialisation : une sécurité des médicaments renforcée »
- Ordre National des Pharmaciens / Communication sur l’authentification des médicaments à usage humain
- Ordre National des Pharmaciens / L’authentification des médicaments intégrée dans les bonnes pratiques de dispensation à l’officine
- Page consacrée aux médicaments falsifiés sur le site de la Commission Européenne
- Questions – Réponses de la Commission Européenne (version 12 de Novembre 2018, document uniquement en Anglais)
- La sérialisation pour tous, le nouveau règlement européen en bande dessinée (GS1)
- Guide méthodologique sérialisation – Lutte contre la falsification des médicaments dans les établissements de santé (Ministère des solidarités et de la santé, Aout 2018)
- Automatisation, système d’information et sérialisation (Journée régionale OMEDIT/ARS/RESAH du 18/01/19 – présentation Alain Chevalier). Retrouvez ci-dessous le support de présentation d’Alain Chevalier sur le thème de la sérialisation lors de la journée régionale « Automatisation de la prise en charge médicamenteuse »



